Periyodik Tabloya Göre Elementlerin Sembolleri Nelerdir? Doğada Bulunan Elementler, Sembolleri ve Özellikleri
Elementler, kimyasal yöntemlerle kendisinden daha basit yapıda maddelere ayrıştırılamayan saf maddelere denir. Bir elementin tüm kimyasal özelliklerin tek başına gösterebilen en küçük parçasına da atom denir. Doğada bulunan elementlerin benzer fiziksel ve kimyasal özelliklerine göre sınıflandırılma ihtiyacından dolayı ortaya periyodik tablo ortaya çıkmıştır. Elementlerin sembolleri ve özellikleri bu tabloda belirli düzene göre yer almaktadır. İşte elementler tablosu…

Doğada yaklaşık olarak 117 element bulunmaktadır. Bu elementler periyodik tabloda atom numarasına göre sıralanmaktadır. Periyodik tabloda yatay satırlara yörünge, düşey sütunlara da grup denilir. Bir elementin simgesi tek bir harften oluşuyorsa büyük harfle, iki ya da daha fazla harften oluşuyorsa ilk harfi büyük ondan sonra gelenler küçük yazılmaktadır. Elementlerin sembolleri ve özellikleri hakkında daha detaylı bilgileri hazırladık. Elementler tablosu ve elementler hakkında ayrıntılı bilgiler…
ELEMENT NEDİR?
Element, kimyasal yöntemlerle kendisinden daha basit yapıda maddelere ayrıştırılamayan saf maddelere denilmektedir. Elementlerin en küçük yapı taşı da atomdur. Kimyanın en önemli konularından biri olan elementler doğada yaklaşık olarak 117 çeşit bulunmaktadır. Üzerinde yıllarca bilimsel çalışmalar yapılmıştır. Elementlerin kendine özgü özellikleri ve sembolleri vardır. Bu sembollerle beraber periyodik tabloda sıralanmışlardır.
ELEMENTLERİN ÖZELLİKLERİ
- Elementlerin her birinin kendine özgü bir sembolü bulunur.
- Elementlerin donma ve erime ve yoğunlaşma dereceleri bulunur.
- Kendi özelliklerini taşıyan en küçük yapı taşına atom ismi verilir.
- Elementlerin her biri aynı cins atomdan meydana gelir.
- Elementlerin hepsi homojendir.
- Bazı elementler fiziksel özelliğine bağlı olarak yanma özelliği de gösterir.
- Elementler kimyasal özellikleri ile beraber, soygaz ya da ametal ve metal olarak ayrılır.
- Elementlerin her biri saf maddeden meydana gelmiştir.
ELEMENTLERİN SEMBOLLERİ
Her elementin kendine özgü sembolleri olduğundan bahsetmiştik. Bu sembollere göre periyodik tabloda sıralanmaktadırlar. Kimyasal formüllerde sembolleri ile kullanılmaktadırlar. En çok kullanılan elementlerin sembolleri şu şekilde:
- Magnezyum = Mg
- Kükürt = S
- Fosfor = P
- Klor = Cl
- Potasyum = K
- Kalsiyum = Ca
- Titanyum = Ti
- Krom = Cr
- Demir = Fe
- Helyum = He
- Lityum = Li
- Hidrojen = H
- Mangan = Mn
- Kobalt = Co
- Karbon = C
- Azot = N
- Oksijen = O
- Flor = F
- Sodyum = S
- Neon = Na
- Alüminyum = Al
- Berilyum = Be
- Bor = B
İLK 20 ELEMENT
Periyodik tabloda ilk 20 element genellikle merak edilen bir konu oluyor. Sizler için ilk 20 elementi sıraladık:
1) H = Hidrojen
2) He = Helyum
3) Li = Lityum
4) Be = Berilyum
5) B = Bor
6) C = Karbon
7) N = Azot
8) O = Oksijen
9) F = Flor
10) Ne = Neon
11) Na = Sodyum
12) Mg = Magnezyum
13) Al = Alüminyum
14) Si = Silisyum
15) P = Fosfor
16) S = Kükürt
17) Cl = Klor
18) Ar = Argon
19) K = Potasyum
20) Ca = Kalsiyum
BAŞ GRUP ELEMENTLERİ
Periyodik tabloda s ve p orbitallerinin dolmakta olduğu A grubu elementlerine baş grup elementleri denilmektedir. 8 tane A grubu bulunur.
1A = Alkali Metaller = Li, Na, K, Rb, Cs, Fr
2A = Toprak Alkali Metalleri = Be, Mg, Ca, Sr, Ba, Ra
3A = Toprak Metalleri (Bor grubu) = B, Al, Ga, In,TI
4A = Karbon grubu = C, Si, Ge, Sn, Pb, FI
5A = Azot grubu = N, P, As, Sb, Bi, Uup
6A = Kalkojenler (Oksijen grubu) =O, S, Se, Te, Po, Lv
7A = Halojenler = F, CI, Br, I, At, Uus
8A = Soy gazlar = He, Ne, Ar, Kr, Xe, Rn, Uuo
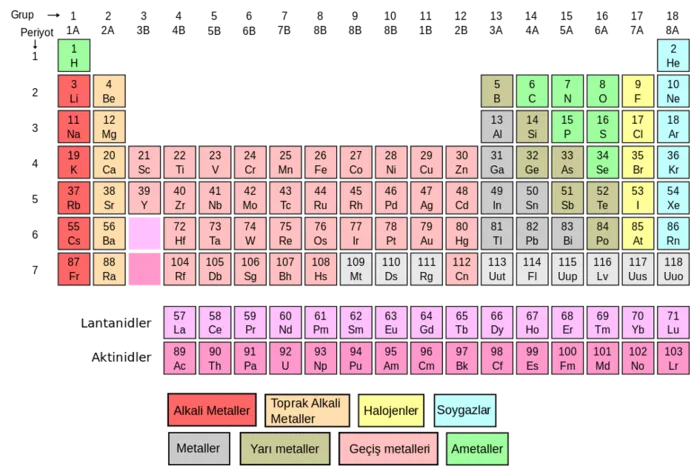
ELEMENTLER TABLOSU
- Kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur.
- Tüm elementlerin atom numarası ile sıralanmasından oluşur.
- Dış katman elektron dizilimi aynı olan elementlerin oluşturduğu birliğe grup denir.
- Aynı gruptaki elementlerin kimyasal özellikleri benzerdir.
- Periyodik tablodaki satırlara periyot denir.
- Altıncı periyot 32 elemente sahip uzun bir periyottur.
- Elementler (hidrojen ve helyum dışında) değerlik orbitallerine göre s,p, d ve f olmak üzere dört ana bloğa ayrılır.
- s ve p ana grup, d ve f yan grup olarak adlandırılır.
- Soldan sağa ya da yukarıdan aşağı gidildikçe düzenli değişen özellikler vardır.
Periyodik tablo elementler şekildedir:
AMETALLERİN ÖZELLİKLERİ
- Isı ve elektriği iletmezler. (Fulleren ve grafit hariç)(fiziksel)
- Yüzeyleri mattır. (fiziksel)
- Kırılgandırlar, tel ve levha haline dönüştürülemezler. (fiziksel)
- Bileşiklerinde hem pozitif hem de negatif değerlikte olabilirler. (kimyasal)
- Oda koşullarında katı,sıvı veya gaz hallerinde bulunabilirler. (fiziksel)
- Elektron almaya isteklidirler çünkü son yörüngelerinde 5,6,7 elektron barındırabilirler. (kimyasal)
- Erime noktaları, kaynama noktaları ve yoğunlukları düşüktür. (fiziksel)
- Kendi aralarında kovalent bağlı bileşik oluştururlar. (kimyasal)
- Metallerle iyonik bağlı bileşik oluştururlar. (kimyasal)
- Oksijenli bileşikleri asidik özellik gösterir. (kimyasal)
- Doğada moleküler halde bulunurlar. (kimyasal)
- 1A grubunda sadece hidrojen ametaldir. (kimyasal)
- Çok küçük cisimlerdir.(fiziksel)
METALLERİN ÖZELLİKLERİ
- Tel ve levha haline getirilebilirler.
- Cıva dışındaki tüm metaller oda sıcaklığında katıdır.
- Işığı yansıtma özellikleri vardır.
- Isı ve elektriği iletirler.
- Nispeten yoğunlukları fazladır.
- Vurulduklarında metal tınılı ses çıkarırlar.
- Gri ve kırmızı renk tonlarındadırlar.
- Yüksek mukavemet değerlerine sahiptirler.
- Kısa mesafeli düzenli atom dizilişine sahiptirler. Buna kristal yapı denilmektedir.
- Bileşik oluşturmazlar. (Alaşım yaparlar)
